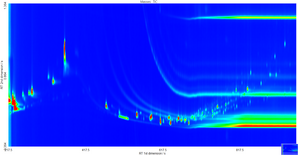
GC X GC TOF MS
Metabolische, physiologische und pathophysiologische Prozesse und deren Mechanismen werden in der Medizin seit Jahren intensiv erforscht. An die „Metabolomics“ wird die Hoffnung geknüpft, neue Erkenntnisse zur Krankheitsentstehung und -verläufen, aber auch grundlegenden physiologischen Prozessen zu gewinnen. Zahlreiche Studien haben Hinweise dafür erbracht, dass aus dem Metabolismus stammende, in der Atemluft nachweisbare flüchtige Substanzen geeignet sind, physiologische und pathophysiologische Prozesse im gesamten Körper abzubilden. Für die klinische Anwendung bietet sich hier die Möglichkeit einer nicht invasiven und ggf. kontinuierlichen Diagnostik bei der pathophysiologische Zustände erkannt und im Verlauf bzw. zur Therapiekontrolle beobachtet werden könnten, ohne den Patienten zu belasten.
Voraussetzung für die vollständige Erfassung der flüchtigen Substanzen ist eine extrem effiziente Trennung der Verbindungen in Kombination mit einer spezifischen Detektion. Dafür müssen mehrdimensionale Trennsysteme eingesetzt werden. Die „comprehensive“ Gaschromatographie (GCxGC) ist aufgrund entsprechend hoher theoretischer Bodenzahl und daraus resultierender Peakkapazität gegenwärtig das einzige System, mit der solch komplexe Trennungen erreicht werden können. In Verbindung mit einem schnellen Massenspektrometer ist eine eindeutige, umfangreiche Identifizierung einzelner Verbindungen möglich (metabolic VOC profiling).
Als Detektoren für die GCxGC kommen Time-of-Flight Massenspektrometer (ToF-MS) oder neuerdings schnellscannende Quadrupol Detektoren in Frage. Auf Grund der hohen Zeit- und Massenauflösungen stellt die ToF-MS die optimale Detektor-Lösung für die GCxGC dar.
In Kombination mit den von uns speziell für solche Applikationen entwickelten, Point-of-Care einsetzbaren Probennahme- und Präkonzentrations Techniken ist ein GCxGC-MS System optimal geeignet, umfassendes VOC Profiling durchzuführen und unbekannte Verbindungen aus der Atemluft zu identifizieren.
PTR-ToF-MS 8000

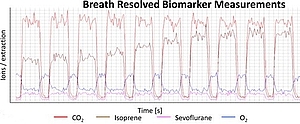
Volatile Verbindungen in der Atemluft der Patienten können physiologische und pathophysiologische Prozesse im gesamten Körper abbilden. Die Atemgasanalyse bietet daher optimale Voraussetzungen zur Einführung patientenorientierter nicht invasiver diagnostischer Methoden für die Früherkennung und Diagnose von Erkrankungen, für die Therapiekontrolle und die Beobachtung physiologischer Effekte. Wegen der geringen Konzentration der relevanten Verbindungen in der Atemluft kommt dem Brückenschlag zwischen Hochleistungsanalytik, klinischer Praxis und praktischer Umsetzung entscheidende Bedeutung zu. Als hochauflösendes Echtzeitmessverfahren ist die PTR-TOF anderen spektrometrischen Verfahren überlegen und bietet damit optimale Voraussetzungen für Identifizierung, Quantifizierung klinisch relevanter (Bio)marker im Ultraspurenbereich in Echtzeit.
Die Protonen-Transfer-Massenspektroskopie (PTR-MS) ist eine inzwischen für den Nachweis gasförmiger Substanzen etablierte Technologie. Die Technik verwendet eine chemische Ionisierung, um volatile organische Verbindungen in Echtzeit nachzuweisen. Der eigentliche Ionisierungsprozess in der „drift tube“ findet im Bereich von ns bis ms statt. Im Gegensatz zu anderen massenspektrometrischen Verfahren ist dieses Verfahren in der Lage, volatile Verbindungen im Spurenbereich ohne relevante zeitliche Verzögerung (atemzugsaufgelöst) zu erfassen. Da die Zielsubstanzen bei der PTR-Ionisierung nicht fragmentiert werden, können diese gut über Ihre molekulare Masse identifiziert werden. Die in bisherigen Gerätegenerationen verwendeten Quadrupol Detektoren limitieren das Potential der Technik, da einerseits nur ein kleine Anzahl verschiedener Molekülmassen (m/z) im Echtzeitmodus erfassbar waren und andererseits isobare Verbindungen mit identischer molekularer Masse nicht unterscheidbar waren. Aufgrund der hohen Auflösung (m/Dm bis zu 8000) und der höheren Messgeschwindigkeit (ca. 500 Da pro Sekunde) ermöglichen die in den Geräten der neuesten Generation verwendete Time-of-flight (TOF)-Detektoren sowohl die parallele Detektion isobarer Substanzen als auch einen sekundenschnellen Scan des gesamten Messbereiches für volatile Verbindungen. Damit ist die PTR-TOF anderen massenspektrometrischen Verfahren überlegen und bietet daher optimale Voraussetzungen für die schnelle Identifizierung und kontinuierliche Quantifizierung klinisch relevanter Biomarker im Ultraspurenbereich.
Das Gerät ergänzt und erweitert das bereits in der Arbeitsgruppe RoMBAT vorhandene Equipment zum nicht-invasiven Nachweis von Biomarkern optimal ergänzen Durch Einsatz dieses Gerätes in einem Netzwerk aus experimenteller Anästhesie und Intensivtherapie (Prof. Dr. D.A. Reuter), Pharmakologie (Institut für klinische Pharmakologie, Prof. Dr. B. Drewelow), experimenteller Chirurgie (Prof. Dr. B. Vollmar), analytischer Chemie (Lehrstuhl für analytische Chemie Prof. Dr. R. Zimmermann) und dem interfakultären Massenspektrometrischen Zentrum konnten insbesondere in Kombination mit den bereits an der KAI etablierten Probenvorbereitungs- und Analysetechniken weitere bisher unbekannte und nur im Spurenbereich vorhandene endogene und exogene Markersubstanzen identifiziert werden. Auf diese Weise kann der an der Fakultät vorhandene Wissensvorsprung im Bereich der Spurenanalytik und der nicht-invasiven medizinischen Diagnostik gefestigt und ausgebaut werden.
Das PTR-TOF-MS 8000 entspricht dem neuesten Stand der massenspektrometrischen Technik. Im Rahmen der Doktorandenausbildung und der bereits etablierten Vorlesungen und Praktika konnte diese hochaktuelle Technologie anschaulich in den Bereich der Lehre eingebunden werden. Auch Doktoranden haben die Gelegenheit sich mit aktueller Hard und Software auf dem Gebiet der Massenspektrometrie auseinander zusetzen. Der prinzipielle Umgang mit dem Gerät und mit den gewonnenen Messdaten stellt eine wertvolle Erweiterung für den Studiengang Biomedizinische Technik dar und kann anschaulich im Rahmen der Praktika (z.B. neue Innovative Methoden am Beispiel der Atemgasanalyse) direkt in die Lehre eingebunden werden.
Ergebnisse aus dem Einsatz der PTR-TOF-MS 8000
Trefz P, Schmidt M, Oertel P, Obermeier J, Brock B, Kamysek S, Dunkl J, Zimmermann R, Schubert JK, Miekisch W. Continuous real time breath gas monitoring in the clinical environment by proton-transfer-reaction-time of flight-mass spectrometry. Anal Chem. 2013 Nov 5;85(21):10321-9.
Sukul P, Trefz P, Schubert JK, Miekisch W. Immediate effects of breath holding maneuvers onto composition of exhaled breath. J Breath Res. 2014 Sep;8(3):037102. doi: 10.1088/1752-7155/8/3/037102. Epub 2014 Sep 4
Sukul P, Trefz P, Kamysek S, Schubert JK, Miekisch W. Instant effects of changing body positions on compositions of exhaled breath. J Breath Res. 2015 Nov 19;9(4):047105. doi: 10.1088/1752-7155/9/4/047105
Sukul P, Schubert JK, Oertel P, Kamysek S, Taunk K, Trefz P, Miekisch W. FEV manoeuvre induced changes in breath VOC compositions: an unconventional view on lung function tests. Scientific Reports 6, Article number: 28029 (2016) doi:10.1038/srep28029
Brock B, Kamysek S, Silz J, Trefz P, Schubert JK, Miekisch W. Monitoring of breath VOCs and electrical impedance tomography under pulmonary recruitment in mechanically ventilated patients. J Breath Res 2017;11(1):016005. DOI: 10.1088/1752-7163/aa53b2
Sukul P, Oertel P, Kamysek S and Trefz P. Oral or nasal breathing? Real-time effects of switching sampling route onto exhaled VOC concentrations. J Breath Res 2017; 11(2): 027101. DOI: 10.1088/1752-7163/aa6368
Obermeier J, Trefz P, Happ J, Staude H, Schubert J K, Fischer D-C, Miekisch W. Exhaled volatile substances mirror clinical conditions in pediatric chronic kidney disease. PLoS One. 2017;12(6): e0178745. DOI: 10.1371/journal.pone.0178745
Sukul, P; Schubert, JK; Kamysek, S; Trefz, P; Miekisch, W. Applied upper-airway resistance instantly affects breath components: a unique insight into pulmonary medicine. 2017; 11(4):047108. DOI: 10.1088/1752-7163/aa8d86
Trefz P, Schubert JK, Miekisch W. Effects of humidity, CO2 and O2 on real time quantitation of breath biomarkers by means of PTR-ToF-MS. J Breath Res 2017;Dec 4. DOI: 10.1088/1752-7163/aa9eea